05 49 01 91 32
FAX : 05 40 54 08 23 Du lundi au jeudi 09h-12h / 14h-19h vendredi et samedi 09h-12h - Entre Noël et Nouvel An ouvert le matin
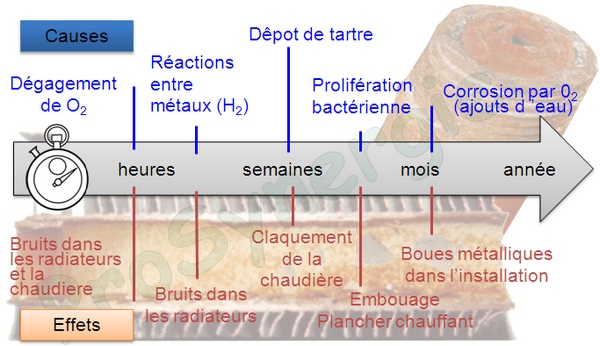
Les différents phénomènes
La protection de votre installation de chauffage central
L’entartrage
A température ambiante, les sels de calcium et de magnésium sont solubles dans l’eau.
Lorsque l’eau de l’installation est chauffée ces sels de déposent principalement dans la chaudière et créent un dépôt isolant

Les bruits de chaudière
Les causes :
Le tartre présent dans l’eau de l’installation se dépose sur les parties les plus chaudes de l’installation et donc principalement dans le corps de chauffe de la chaudière.
Les conséquences :

La corrosion des métaux
La réaction de corrosion des métaux traduit leur tendance naturelle à revenir à l’état d’oxyde. Ainsi, l’acier corrodé produit de l’oxyde de fer.
Les différents types :
- La corrosion par l’oxygène
- La corrosion acide
- La corrosion par piqûres liée aux chlorures
- La corrosion galvanique (intermétallique)
- La corrosion sous dépôt
- La corrosion érosion
- La corrosion sous contrainte
La corrosion par l’oxygène :
- L’oxygène attaque le fer pour lui arracher ses électrons.
- Le fer privé d’électrons se dissout dans l’eau.
- Le fer dissout évolue avec le temps vers une forme solide : l’oxyde de fer appelé communément boue.

L’usure prématurée des circulateurs
Les causes :
Les boues sont abrasives et endommagent le rotor des circulateurs de chaudière.

Oxygène dissous
- Vidange et remplissage de l’installation
- Défauts d’étancheité de l’installation
- Utilisation de matériaux perméables à l’oxygène
Corrosion et pH
pH signifie potentiel d’hydrogène . Il mesure l’acidité d’une eau.
- Si pH < 7 l’eau est acide
- Si pH = 7 l’eau est neutre
- Si pH > 7 l’eau est basique
En absence de traitement anti-corrosion les métaux sont sensibles au pH :
- L’aluminium corrode lorsque pH < 4.5 et pH > 8.5
- Le fer corrode lorsque pH < 9.6
- Le cuivre corrode pour pH < 7 et pH > 12
La corrosion galvanique
2 métaux de nature différente en contact dans l’eau forment une pile électrochimique.
Le métal de potentiel le plus bas (anode) se corrode tandis que le métal de potentiel plus élevé (cathode) reste intact.
Les réactions sont significatives pour des différences de potentiel supérieures à 50 mV.
Potentiels électrochimiques des métaux :
| OR : | + 250mV |
| CUIVRE : | + 40mV |
| BRONZE : | 0mV |
| SOUDURE : | - 180mV |
| ETAIN : | - 400mV |
| FONTE : | - 470mV |
| ACIER : | - 400mV |
| GALVA : | - 800mV |
| ZINC : | - 850mV |
| MAGNESIUM : | - 1350mv |
| ACIER INOX : | +250mV à -100mV |
| ALUMINIUM et alliages : |
-350mV à -700mV |

Dézincification du laiton

La corrosion sous dépôts

L’embouage des planchers chauffants


Les solutions sentinel



 Conditions de Transport
Conditions de Transport Paiement sécurisé
Paiement sécurisé Demande de devis
Demande de devis Contact
Contact Mon compte
Mon compte




 Outillage
Outillage